最新资讯
咨询热线
电话:020-22091047
手机:13660676656
邮箱:2174088611@qq.com
地址:广州市番禺区南村镇陈边村金瓯东路18号金东青创园A栋601
脂质体载药纳米技术
脂质体载药技术在生物医药领域已经取得了很大的突破,许多研究资料都展示了脂质体在负载药物组分、克服细胞组织摄取障碍以及提高体内靶向位点药物分布等方面的优势,而这些特性确保了脂质体包封的药物组分能够靶向地递送到人体特定部位,从而提高药效并使毒副作用最小化。
脂质体是由一个或多个同心脂质双层膜闭合形成的磷脂囊泡,囊泡内部具有隔离的亲水相和亲脂相空间。这一独特的结构使得大多数亲水和亲油的药物能被包封在囊泡内部。其中水溶性药物包封在内水相中,而脂溶性药物包封在脂质层中(其结构如图1)。除此之外,脂质体内部较大的水相空间和外部生物相容性的脂质能够传质像DNA、蛋白质和造影剂等大分子。

图1 不同种类的脂质体载药系统原理图[1]
目前脂质体可以分为几大种类,图1阐述了不同种类脂质体载药原理。其中A类为传统脂质体,由阴阳离子型磷脂脂质、胆固醇以及其围成的水相内核组成。内水相和磷脂层分别能够包载水溶性和脂溶性组分。传统脂质体通过改变药物代谢和生物分布来增强药物递送到疾病组织,从而降低了药物组分在体内的生物毒性。但是这种脂质体递送系统在血液流动中很容易被快速清除,从而限制了其实际疗效。
B类为PEG化的脂质体,脂质体在体内特别是血液内的行为特性可以通过表面修饰PEG亲水层改性。PEG表面修饰能够在脂质体外层形成亲水层的空间屏障,而这层亲水的空间屏障能够减弱体内血清的调理素作用和避免网状内皮系统的捕获,从而提升脂质体的空间稳定性,增加载药脂质体在血液中的循环次数。这不仅延长了血液循环时间,也增加了药物在病变位点的累积,减轻药物副作用。除此之外,PEG修饰的长循环脂质体还能提高脂质体的被动靶向性,已经广泛应用于脂质体药物制剂的开发中。
C类为配体靶向性脂质体,在脂质体表面或者PEG长链的终端接枝一种识别分子(即配体),通过配体分子的特异性和专一性,与靶细胞表面的受体分子相互作用而使脂质体在靶区释放药物。这类脂质体利用靶向配体偶联到脂质体表面来选择性的传递药物到目标部位,通常被认为是“主动靶向”载体,其配体包括抗体分子、抗体片段、小分子量的天然或者合成配体(如叶酸、多肽、糖类化合物、糖蛋白)和其他蛋白质等。选择不同配体与脂质体相连,将对不同受体阳性细胞具有专一的靶向性,可以根据给药的需要来选择脂质体的配体。
D类为治疗一体化脂质体,由纳米颗粒、靶向单元、造影剂组分和治疗剂组分组成,可在前面三类脂质体基础上进行构建。例如将精确靶向的抗体偶联到PEG化长循环脂质体表面,并同时负载药物和标记核素,可实现靶向递送和诊疗一体化。
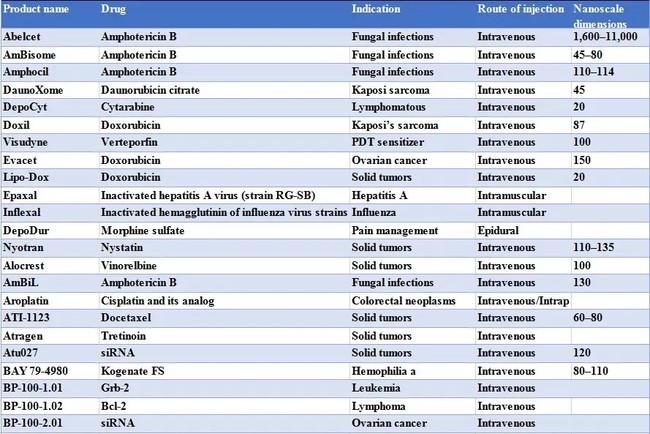
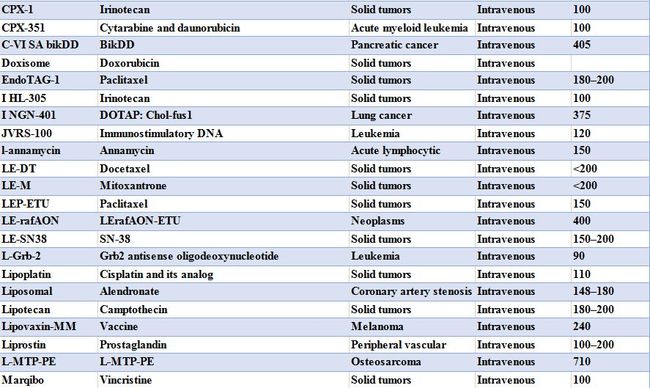

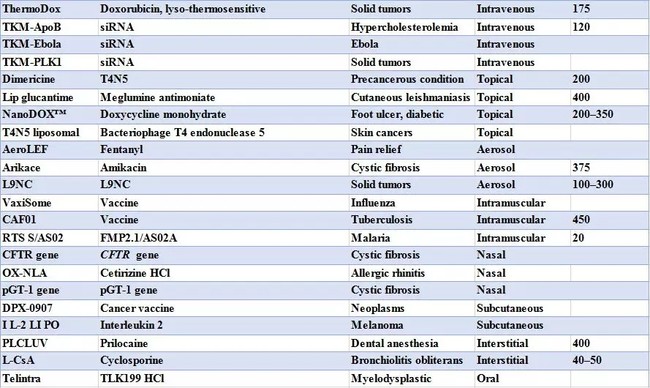
表 1 目前已经上市和正在临床试验的载药脂质体种类[2]
南京东纳生物科技有限公司专注于生物医用纳米材料与技术的研发,全面布局各种脂质体载药平台技术,以及脂质体延伸材料的定制服务。除了上述4种类型的脂质体,还包括磁性脂质纳米颗粒、载双药或者多药脂质体、热敏脂质体、酸敏脂质体、脂质体的表面修饰以及诊疗一体化脂质体。
磁性脂质体是将磁性纳米颗粒(磁性Fe3O4纳米颗粒)包封在脂质体内部,能够实现磁共振成像示踪及快速磁分离(高效磁分离柱,东纳生物出品)。外层的脂质仍然可以包封脂溶性药物,形成载药磁性脂质体。磁性脂质体是一种新型物理靶向脂质体,也是磁导向药物传递系统中的一种新型药物载体,既具有磁流体性能,又具有脂质体功能。当进入人体后,利用体外磁场的效应可以引导药物在体内定向移动和定位集中的靶向给药,使其靶向性和专一性更强,诊断治疗更加准确、快速,从而达到高效、速效、低毒的效果。如利用PEG化的高性能磁性Fe3O4纳米颗粒作为磁共振造影剂,在小鼠肿瘤部位磁共振成像,评价肿瘤EPR被动靶向效果,从而指导纳米药物的用药,同时还可以构建多功能诊疗体系
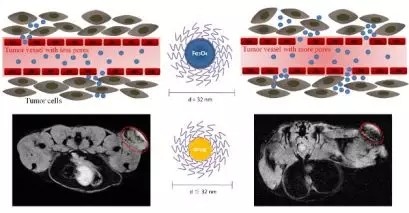
图2 磁性Fe3O4脂质纳米颗粒经MRI描述肿瘤EPR效应
用于预测胶束药物疗效的示意图(Nanoscale, 2018, 10, 1788)
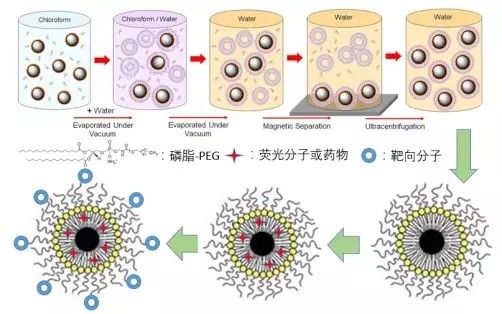
图3 磁性脂质纳米颗粒PEG化、荧光或药物分子负载及表面偶联特异性靶向分子
(Biomaterials 2014,35:9126;Nanoscale 2016, 8, 16902)
载多药脂质体是在脂质体内包封多种药物,能够结合多种药物的复合作用机制,达到更好的治愈效果。水溶性的药物一般包封在磷脂双分子层内部水相空间中,而脂溶性药物嵌入脂质层中。载多药脂质体的包封率和载药率根据不同的药物分子和不同的磷脂脂质会有不同,总体上载药量可以在最大载药量以下调变。
功能性脂质体多利用功能性磷脂已达到特定的脂质体性质,如DPPC热敏脂质体及PAE-PEG酸敏脂质体等。通常采用这种不同环境下产生相变的磷脂来包封药物,体内给药后在病变位置利用达到一定的相变条件,使得脂质体局部位置产生相变而加速释药,增加了药物在靶区域的分布,降低了网状内皮系统对脂质体的清除。如图4酸敏脂质体根据脂质材料特性,不同pH下材料改性从而快速释药。
脂质体边缘化的产品包括在不同的纳米粒子表面进行磷脂PEG修饰以及在不同的脂质体表面修饰或包封其他组分。另外还可以根据客户需求定制研发更多的纳米技术解决方案。
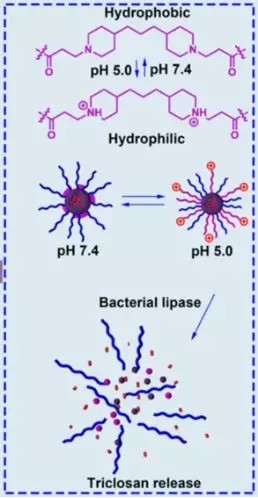
图4 酸敏脂质体中不同pH的药物释放原理示意图[3]
参考文献:
[1] Sercombe L, Veerati T, Moheimani F, et al. Advances and challenges of liposome assisted drug delivery[J]. Frontiers in pharmacology, 2015, 6: 286.
[2] Bozzuto G, Molinari A. Liposomes as nanomedical devices[J]. International journal of nanomedicine, 2015, 10: 975.
[3] Liu Y, Busscher H J, Zhao B, et al. Surface-adaptive, antimicrobially loaded, micellar nanocarriers with enhanced penetration and killing efficiency in staphylococcal biofilms[J]. ACS nano, 2016, 10(4): 4779-4789.




